Svojstva elektrolita. Jake i slabe elektrolite. Elektroliti - što je to?
Odlična električni vodiči - zlato, bakar, željezo, aluminij, legura. Zajedno s njima, postoji velika skupina nemetalnih materijala, talina i vodene otopine koji posjeduju svojstvo vodljivosti. Ovaj jake baze, kiseline, neke soli, koji se skupno "elektroliti", Što je ionska vodljivost? Pogledajmo što imaju elektrolita tvar za zajednički.
sadržaj
- Koji čestice nose troškove?
- Voda, ne-elektroliti i elektrolita. Što je raspad?
- Teorija elektrolitske disocijacije
- Video: §39, 9 stanice. disocijacija elektrolita u vodenim otopinama
- Svojstva elektrolita
- Video: elektroliti
- Kemijska interakcija između elektrolita
- Voda - jedan od najvažnijih slabih elektrolita
- Video: karboksilna kiselina - slaba elektrolita

Koji čestice nose troškove?
Širom svijeta je pun raznih vodiča i izolatora. Ta svojstva tijela i tvari poznate od davnina. Grčki matematičar Tales je imao iskustva s jantara (na grčkom - „elektron”). trljanje na svili, znanstvenici su primijetili pojavu gravitacije kose, vune. Kasnije je postalo poznato da je jantar je izolator. U ovom slučaju ne postoje čestice koje bi mogle nose električni naboj. Dobri vodiči - metali. U svojoj strukturi atomima prikazuju, pozitivnih iona i slobodan, vrlo mali negativne čestice - elektrona. Oni pružaju troškove prijenosa kad je prošao aktualni. Jaki elektroliti u suhom obliku ne sadrže slobodne čestice. No, kada otapanje i topi u kristalnu rešetku je uništen i polarizacija kovalentnu vezu.
Voda, ne-elektroliti i elektrolita. Što je raspad?
Plaćanje ili pričvršćivanje elektrona, atomi metalnih i nemetalnih elemenata pretvoren u ione. Između njih u kristalnoj rešetki ima dosta jaka veza. Otapanje ili taljenja ionskih spojeva, npr, natrij klorid, vodi do uništenja. U ne polarnih molekula povezana ili slobodnih iona, proizlazi iz interakcije s vodom. U 30-tih godina XIX stoljeća, Michael Faraday je otkrio da rješenja nekih tvari provodi struju. Znanstvenik uvodi u znanost važnim pojmovima:
- ioni (nabijene čestice);
- elektrolita (drugi vrste vodiča);
- katoda;
- anoda.
Ima veze - jaki elektroliti, kristalna rešetka koja je potpuno uništeni s otpuštanjem iona.

Postoji netopljivi materijali i oni koji su pohranjeni u molekularnom obliku, na primjer, šećer, formaldehid. Takvi spojevi se nazivaju ne-elektrolite. Za njih karakterizira formiranje nabijenih čestica. Slabe elektrolita (ugljična kiselina i octena kiselina, amonijev hidroksid i niz drugih tvari) sadrži nekoliko ione.
Teorija elektrolitske disocijacije
U svojim djelima, švedski znanstvenik S. Arrhenius (1859-1927) temelji se na Faraday zaključke. U dodatno pojasniti poziciju svoje teorije ruskih istraživača I. pete i B. Kistyakovsky. Otkrili su da su otapanje i taljenje oblika ioni ne samo da sve tvari i elektrolita. Što je disocijacija S. Arrhenius? To je uništavanje molekula, koja dovodi do nabijenih čestica u rješenjima i topi. Glavni teorijski položaj S. Arrhenius:
- Baze, kiseline i soli u otopini su u disociranom obliku.
- Reverzibilno ograditi na ione jakih elektrolita.
- Slab oblik malih iona.

Video: §39, 9 stanice. Disocijacija elektrolita u vodenim otopinama
pokazatelj stupanj disocijacije Tvar (često izražena kao postotak) je omjer broja molekula na ione raskinuti i ukupnog broja čestica u otopini. Elektroliti su jaki, ako je vrijednost ovog parametra preko 30%, na slab - manje od 3%.
Svojstva elektrolita
Teoretski zaključci S. Arrhenius dopunjena i novija istraživanja fizikalnih i kemijskih procesa u otopinama i talina, provedena od strane ruskih znanstvenika. Dobila objašnjenje svojstva baza i kiselina. Bivši uključuju spojeve samo metalnih iona koji se mogu detektirati u otopini od kationa, anioni su čestice OH--. Molekule kiseline spadaju u negativne ione ostataka kiseline i vodikovih protona (H+). Kretanje iona u otopini i otopiti - kaotičan. Uzeti u obzir rezultate eksperimenta za koji je potrebno prikupiti lanac, da uključuje ugljika elektrode i obična žarulja žarulja. Provjeriti vodljivost otopina različitih tvari: natrijev klorid, šećer i octene kiseline (prva dva - elektrolitima). Što je električni krug? Ovaj izvor struje i vodiči međusobno. Kada je zatvoren krug žarulja će izgorjeti svjetlije u slanoj otopini. Kretanje iona dobiva urednost. Anioni su usmjerena na pozitivne elektrode i kationa - da je negativan.
U ovom postupku, octena kiselina je uključena u maloj količini nabijenih čestica. Šećer nije elektrolit ne provodi struja. Između elektroda na ovo rješenje će biti izolacijski sloj, svjetlo neće upaliti.
Video: Elektroliti
Kemijska interakcija između elektrolita
Kada pražnjenje tekućine može promatrati ponašanje elektrolita. Što je ionski jednadžbe takvih reakcija? Razmotrimo primjer kemijske interakcije između barijev klorid i natrijev nitrat:
2NaNO3 + BaC2 + = 2NaCl + Ba (NO3)2.
Elektrolit formula može pisati u ionskom obliku:
2Na+ + 2NO3 + ba2+ + 2 Cl- = 2Na+ + 2 Cl- + ba2+ + 2NO3.
Reakcijska uzeti tvar - jaka elektrolite. U tom slučaju, sastav iona ne mijenja. Kemijska interakcija između elektrolita rješenja možda u tri slučaja:
1. Ako je proizvod netopljiva tvar.
Molekulska jednadžba: Na2SO4 + BaC2 = BaSO4 + 2NaCl.
Pišemo sastav elektrolita u obliku iona:
2Na+ + SO42- + ba2+ + 2 Cl- = BaSO4 (bijeli talog) + 2Na+ 2 Cl-.
2. Jedan od dobivenih proizvoda - plin.
3. Među produktima reakcije je slab elektrolit.
Voda - jedan od najvažnijih slabih elektrolita
kemijski čista voda (destilirana), To ne provode električnu struju. No, u svom sastavu imaju mali broj nabijenih čestica. To protone H+ i anioni OH-. Disocijacija prolazi zanemariv broj molekula vode. Tu vrijednost - ionski produkt vode koja je konstantna na 25 ° C To vam omogućuje da znate koncentraciju H+ i OH-. Prevladavajućih vodikovih iona u kiselim otopinama, hidroksid anioni više u lužinama. U neutralan - istom količinom H+ i OH-. Medij također karakterizira otopina pH vrijednosti (pH). Veća je, više hidroksid ioni prisutni. Srednja je neutralan u rasponu pH vrijednosti blizu 7,6. U prisutnosti H+ i OH- promijeniti svoje boje indikatora tvari: lakmus, fenolftalein, metiloranža i drugima.
Video: Karboksilna kiselina - slaba elektrolita
Svojstva rješenja i topi elektrolita su naširoko koristi u industriji, inženjering, poljoprivrede i medicine. Znanstveno opravdanje postavio nizom istaknutih znanstvenika objasniti ponašanje čestica koje se sastoje od soli, kiseline i baze. Ove otopine se javljaju višestruki reakciju ionske izmjene. Oni se koriste u mnogim industrijskim procesima, elektrokemije, galvansko. Procesi u živim bićima također se javljaju između iona u otopini. Mnogi metala i nemetala, toksični u obliku atoma i molekula, prijeko u obliku nabijenih čestica (natrij, kalij, magnezij, klora, fosfora i dr.)
 Jantar za liječenje štitnjače: kako nositi, korištenje
Jantar za liječenje štitnjače: kako nositi, korištenje Izolacijski materijali i njihova klasifikacija. Materijali vlakana izolacijski
Izolacijski materijali i njihova klasifikacija. Materijali vlakana izolacijski U boji, plemenitih metala i željeza vrsta i njihova karakterizacija
U boji, plemenitih metala i željeza vrsta i njihova karakterizacija Disocijacija soli, kiseline i lužine. Teorija i praktična primjena
Disocijacija soli, kiseline i lužine. Teorija i praktična primjena Što je disocijacija vode?
Što je disocijacija vode? Stupanj disocijacije slabih i jakih elektrolita
Stupanj disocijacije slabih i jakih elektrolita U nekim slučajevima, konstanta disocijacije nema smisla?
U nekim slučajevima, konstanta disocijacije nema smisla? Koncept hidrolize. Numerički karakteristike procesa hidrolize: konstanta i stupanj hidrolize
Koncept hidrolize. Numerički karakteristike procesa hidrolize: konstanta i stupanj hidrolize Teorija elektrolitske disocijacije. Jednostavan objašnjenje složene procese
Teorija elektrolitske disocijacije. Jednostavan objašnjenje složene procese Natrijev karbonat, natrijev hidrogenkarbonat - Najzanimljiviji
Natrijev karbonat, natrijev hidrogenkarbonat - Najzanimljiviji Rješenje Elektroliza: opis, korištenje
Rješenje Elektroliza: opis, korištenje Polarizacija dielektrika
Polarizacija dielektrika Ioni - su atomi koji nose naboj
Ioni - su atomi koji nose naboj Rutherford planetarni model atoma Rutherford modela
Rutherford planetarni model atoma Rutherford modela Metali: opće karakteristike metala i legura
Metali: opće karakteristike metala i legura Struktura atoma. Kvantno mehanički-model atoma
Struktura atoma. Kvantno mehanički-model atoma Kvantni brojevi i njihovo fizičko značenje
Kvantni brojevi i njihovo fizičko značenje Lužina - ova baza ili ne? Koje su njegove osobine?
Lužina - ova baza ili ne? Koje su njegove osobine? Što je valencija sumpora? Moguće valencije sumpora
Što je valencija sumpora? Moguće valencije sumpora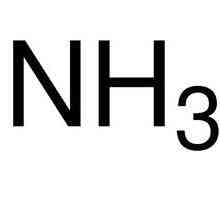 Određuje valenciji kemijskih elemenata
Određuje valenciji kemijskih elemenata Sastav atomska jezgra. jezgra atoma
Sastav atomska jezgra. jezgra atoma


 U boji, plemenitih metala i željeza vrsta i njihova karakterizacija
U boji, plemenitih metala i željeza vrsta i njihova karakterizacija Kvantni brojevi i njihovo fizičko značenje
Kvantni brojevi i njihovo fizičko značenje Struktura atoma. Kvantno mehanički-model atoma
Struktura atoma. Kvantno mehanički-model atoma Ioni - su atomi koji nose naboj
Ioni - su atomi koji nose naboj Što je valencija sumpora? Moguće valencije sumpora
Što je valencija sumpora? Moguće valencije sumpora Rutherford planetarni model atoma Rutherford modela
Rutherford planetarni model atoma Rutherford modela Toplinska vodljivost zraka - što je to?
Toplinska vodljivost zraka - što je to?