Kvalitativna ispitivanja fenola. Priprava fenoli: Reakcija
Video: Jedinstvena kemijskih reakcija, Eksperimentalna kemija.
sadržaj
- Video: jedinstvena kemijskih reakcija, eksperimentalna kemija.
- Fenol (hidroksibenzen)
- Značajke molekularne strukture
- Kiseli svojstva
- Video: kako fenol
- Fenol reakcija s natrij i alkalnom
- Reakcije sa benzenskim prstenom
- Kvalitativna ispitivanja fenola. popis
- Video: kvalitativna reakcije prema fenolu
- Dobivanje fenole
- Upotreba fenola
Karboličan kiselina - jedno od imena fenol, što ukazuje na posebnu ponašanje u kemijskim procesima. Ovaj materijal je lakše nego benzen ulazi u reakciji nuklealne supstitucije. Inherentni svojstva spoja objašnjene mobilnosti kiseli vodikov atom u hidroksilne grupe vezane na prsten. Studija molekulske strukture i kvalitetnog odgovor kako bi se fenolni spoj uključuju aromatske spojeve - benzena derivate.
Fenol (hidroksibenzen)
1834, njemački kemičar Runge dodijeljen karbolne kiseline iz katrana kamenog ugljena, ali nije mogao dešifrirati njegov sastav. Kasnije, druga istraživanja su predložili formulu, a ostvaruje novu vezu na aromatski alkohol. Najjednostavniji Predstavnik ove skupine - fenol (hidroksibenzen). U čistom obliku, ova supstanca je transparentan kristal ima karakteristični miris. Klima fenol boja može promijeniti postati ružičaste ili crvene boje. Za aromatskog alkohola tipično slabe topljivosti u vodi i hladnim dobra - u organskim otapalima. Fenola topi na temperaturi od 43 ° C Je otrovan spoj, u dodiru s kožom izaziva teške opekotine. Aromatski dio je radikal fenil (C6H5-). Izravno s jednim od atoma ugljika kisika vezan sa hidroksilnu skupinu (-OH). Prisutnost svake od čestica pokazuje odgovarajuću kvalitativnu reakciju fenola. Formula prikazuje ukupni sadržaj kemijskih elemenata atoma u molekuli - C6H6O. Struktura odražava strukturna formula Kekule ciklus i koji sadrže funkcionalne skupine - hidroksil. Vizualni prikaz molekule, aromatski alkohol dobije sharosterzhnevye model.

Značajke molekularne strukture
Smetnje u benzenski prsten i OH skupine definira kemijsku reakciju fenola s metalima, halogena, drugim tvarima. Nakon vezana na aromatski prsten preko atoma kisika dovodi do redistribucije gustoće elektrona u molekuli. Komunikacija O-H polarniji, što rezultira povećanim mobilnosti vodika u hidroksilnu skupinu. Proton može biti zamijenjena s atomima metala, što ukazuje da kiselosti fenola. S druge strane, OH skupina povećava reaktivne svojstva benzenskog prstena. Delocalization elektrona raste, i sposobnost da se elektrofilnom supstitucijom u jezgri. To povećava pokretljivost vodikovih atoma vezan na ugljikov atom u orto i para položaj (2, 4, 6). Ovaj učinak je zbog prisutnosti donora gustoćom elektrona - hidroksilne skupine. Zbog svog utjecaja fenol aktivne od benzena ponaša reakcijama s određenih tvari i nove supstituenata orijentiranih u orto- i para-pozicija.

Kiseli svojstva
Hidroksilna skupina atomu aromatskog alkohola kisika dobiva pozitivan naboj, slabljenje komunikaciju s vodikom. proton otpuštanje olakšava kako fenol se ponaša kao slabe kiseline, a jači od alkohola. Kvalitativni reakcija fenol uključuje ispitivanje lakmus test u prisutnosti protona promijeni boju od plave u ružičastu. Prisutnost atoma halogena ili nitro skupine povezane s benzenskim prstenom, dovodi do povećanja aktivnosti vodika. Učinak je promatrana u molekulama nitro fenola. Niži kiselost skupinu kao što je amino skupina, i alkil (CH3-, C2H5-, i sl). Spojevi koji donosi zajedno benzenski prsten, hidroksilnu skupinu i metilni radikal, odnosi kresola. Svojstva su slabiji od karbolne kiseline.
Video: Kako fenol
fenol reakcija s natrij i alkalnom
 Slično kiseline fenol reagira s metalima. Na primjer, reagira s natrijevim: 2C6H5-OH + 2Na = 2C6H5-ONA + H2&uarr-. formirana natrij fenoksid, i oslobađa se plin vodik. Fenol reagira s topljivim bazama. je reakcija neutralizacije kako bi se dobilo sol i voda: C6H5-OH + NaOH = C6H5-ONA + H2O. Sposobnost da se dobije vodika u hidroksilne skupine na fenola niži nego većina anorganskim i karboksilnih kiselina. To se pomiče iz soli otopljenih u vodi i ugljičnog dioksida (ugljična kiselina). Reakcijska jednadžba: C6H5-ONa + CO2 + H2O = C6H5-OH + NaHCO3.
Slično kiseline fenol reagira s metalima. Na primjer, reagira s natrijevim: 2C6H5-OH + 2Na = 2C6H5-ONA + H2&uarr-. formirana natrij fenoksid, i oslobađa se plin vodik. Fenol reagira s topljivim bazama. je reakcija neutralizacije kako bi se dobilo sol i voda: C6H5-OH + NaOH = C6H5-ONA + H2O. Sposobnost da se dobije vodika u hidroksilne skupine na fenola niži nego većina anorganskim i karboksilnih kiselina. To se pomiče iz soli otopljenih u vodi i ugljičnog dioksida (ugljična kiselina). Reakcijska jednadžba: C6H5-ONa + CO2 + H2O = C6H5-OH + NaHCO3.
Reakcije sa benzenskim prstenom
Aromatski svojstva zbog elektron delocalization u benzena jezgri. Vodika iz prstena supstituiran s atomima halogena, nitro. Sličan postupak u molekuli fenolne je lakše nego benzena. Jedan primjer - bromiranja. Benzen halogen djeluje u prisutnosti katalizatora, dobivenog bromobenzena. Fenol reagira s bromom vodom pod normalnim uvjetima. Interakcija bijelog taloga 2,4,6-tribromophenol, čiji izgled razlikovati test tvar sličnu njega iz aromatskih spojeva. Bromiranje - kvalitativni reakciji fenola. Jednadžba: C6H5-OH + = 3Br2 C6H2Br3 + HBr. Drugi reakcijski produkt - bromovodik. U interakciji s razrijeđenom fenola dušična kiselina Dobije nitro. Produkt reakcije s koncentriranom dušičnom kiselinom - 2,4,6-trinitrophenol ili pikrinska kiselina ima veliki praktično značenje.

Kvalitativna ispitivanja fenola. popis
U interakciji tvari dobivene određene namirnice koje vam omogućuju da postavite kvalitativni sastav polaznih materijala. Niz reakcije boja pokazuje prisustvo čestica, funkcionalne skupine koje su korisne za kemijske analize. Reakcijska kvalitativno dokazati postojanje fenola po molekuli tvari aromatski prsten, a OH- grupe:
Video: Kvalitativna reakcije prema fenolu
- Otopina fenola plava lakmus papir crvene boje.
- Obojene reakcije fenola također provesti u slabo alkalnom mediju s diazonij soli. Žuti ili narančaste boje. Azo
- Reagira s bromom u vodi smeđi talog se pojavi bijeli tribromophenol.
- U reakciji sa otopinom feri klorid dobiven fenoksid feri - tvar plave, ljubičaste ili zelenog boje.

dobivanje fenole
Fenol Proizvodnja u industriji je u dvije ili tri faze. U prvoj fazi benzena i propilena u prisutnosti aluminijev klorid dobiti Kumen (izopropilbenzen generičko ime). Jednadžba reakcije Friedel-Crafts reakcije: C6H5-OH + C3H6 = C9H12 (kumil). Benzena i propilen u omjeru od 3: 1 se prevodi preko kiselog katalizatora. Sve, umjesto tradicionalnog katalizator - aluminij klorid - ekološki čiste zeoliti. U završnoj fazi oksidacije se provodi s kisikom, u prisutnosti sumporne kiseline: C6H5-C3H7 + O2 = C6H5-OH + C3H6O. Fenoli mogu biti izvedeni iz destilacijom ugljena su intermedijeri u proizvodnji drugih organskih tvari.

Upotreba fenola
Aromatski alkoholi su naširoko koristi u plastične industrije, boje, pesticidi i druge tvari. karboličan proizvodnju kiselina benzena je prvi korak u stvaranju niza polimera, uključujući i polikarbonata. Fenol reagira s formaldehidom, dobije se fenol-formaldehidnih smola.

Cikloheksanol je sirovina za proizvodnju poliamida. Fenoli se koriste kao antiseptici i dezinficijensi u dezodoransa, losiona. Koristi se za dobivanje fenacetina, salicilne kiseline i drugih lijekova. Fenoli se koriste u proizvodnji smole koje se koriste u električnim proizvoda (prekidači, utičnice). Također se koriste u pripravi azo boja, kao što je fenilamin (anilina). Pikrinska kiselina, što je nitro derivati fenola koji se koriste za bojenje tkiva eksplozivom proizvodnju.
 Tekući Castellani, svojstva i primjena pravila.
Tekući Castellani, svojstva i primjena pravila.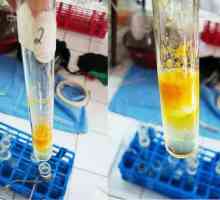 Ksantoproteinovaya reakcija na protein: znakovi i jednadžbe
Ksantoproteinovaya reakcija na protein: znakovi i jednadžbe Otopina „Fukortsin„: struktura, svojstva, indikacije
Otopina „Fukortsin„: struktura, svojstva, indikacije Od prijatelja iz djetinjstva Zelenka - vodič omogućuje da za korištenje?
Od prijatelja iz djetinjstva Zelenka - vodič omogućuje da za korištenje? Upotreba fenola
Upotreba fenola Lijek "Fukortsin". Upute za upotrebu
Lijek "Fukortsin". Upute za upotrebu Karbolne kiseline
Karbolne kiseline Ljekovita svojstva i prednosti breze katrana za ljudsko zdravlje
Ljekovita svojstva i prednosti breze katrana za ljudsko zdravlje Prešanje plastike kod kuće.
Prešanje plastike kod kuće. Castellani boje: Upute za uporabu
Castellani boje: Upute za uporabu Klasifikacija organskih tvari - temelj studija organske kemije
Klasifikacija organskih tvari - temelj studija organske kemije Priprema aldehida i njihove reakcije
Priprema aldehida i njihove reakcije Organska tvar njihove karakteristike i klasifikacija
Organska tvar njihove karakteristike i klasifikacija Sumporna kiselina. Formula, svojstva, priprema i korištenje
Sumporna kiselina. Formula, svojstva, priprema i korištenje Amonijev acetat. Priprava laboratoriju i industrijskim postupkom. primjena
Amonijev acetat. Priprava laboratoriju i industrijskim postupkom. primjena Natrijev karbonat, natrijev hidrogenkarbonat - Najzanimljiviji
Natrijev karbonat, natrijev hidrogenkarbonat - Najzanimljiviji Reakcije supstitucije: opis, primjere jednadžbi
Reakcije supstitucije: opis, primjere jednadžbi Halogenirani ugljikovodici: dobivanje, kemijska svojstva, upotreba
Halogenirani ugljikovodici: dobivanje, kemijska svojstva, upotreba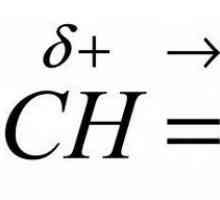 Markovnikov je pravilo. V. esencija i primjeri
Markovnikov je pravilo. V. esencija i primjeri Organski i mineralni spoj. Klasifikacija organskih spojeva
Organski i mineralni spoj. Klasifikacija organskih spojeva Formula toluen: što je toluen, i kako to dobiti?
Formula toluen: što je toluen, i kako to dobiti?
 Castellani boje: Upute za uporabu
Castellani boje: Upute za uporabu Reakcije supstitucije: opis, primjere jednadžbi
Reakcije supstitucije: opis, primjere jednadžbi Halogenirani ugljikovodici: dobivanje, kemijska svojstva, upotreba
Halogenirani ugljikovodici: dobivanje, kemijska svojstva, upotreba Kvalitativna reakcije za organske tvari aniona, kationa
Kvalitativna reakcije za organske tvari aniona, kationa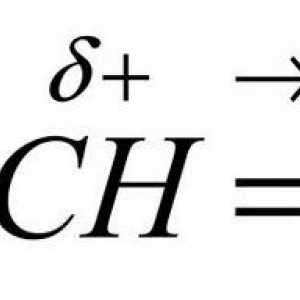 Markovnikov je pravilo. V. esencija i primjeri
Markovnikov je pravilo. V. esencija i primjeri